Carbonate de diméthyle
| Carbonate de diméthyle | |||
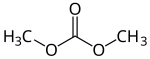 | |||
| Structure du carbonate de diméthyle. | |||
| Identification | |||
|---|---|---|---|
| No CAS | 616-38-6 | ||
| No ECHA | 100.009.527 | ||
| No CE | 210-478-4 | ||
| PubChem | 12021 | ||
| ChEBI | 36596 | ||
| SMILES | COC(=O)OC PubChem, vue 3D | ||
| InChI | Std. InChI : vue 3D InChI=1S/C3H6O3/c1-5-3(4)6-2/h1-2H3 Std. InChIKey : IEJIGPNLZYLLBP-UHFFFAOYSA-N | ||
| Propriétés chimiques | |||
| Formule | C3H6O3 [Isomères] | ||
| Masse molaire[1] | 90,077 9 ± 0,003 7 g/mol C 40 %, H 6,71 %, O 53,29 %, | ||
| Propriétés physiques | |||
| T° fusion | 0,5 à 4,7 °C[2] | ||
| T° ébullition | 90 °C[2] à 1 atm | ||
| Solubilité | 139 g·l-1[2] à 20 °C | ||
| Paramètre de solubilité δ | 20,3 J1/2·cm-3/2 (25 °C)[3] | ||
| Masse volumique | 1,063 6 g·cm-3[2] à 25 °C | ||
| T° d'auto-inflammation | 458 °C[2] | ||
| Point d’éclair | 16,7 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
 Danger H225 : Liquide et vapeurs très inflammables P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer. P233 : Maintenir le récipient fermé de manière étanche. P240 : Mise à la terre/liaison équipotentielle du récipient et du matériel de réception. P243 : Prendre des mesures de précaution contre les décharges électrostatiques. P403+P235 : Stocker dans un endroit bien ventilé. Tenir au frais. | |||
| Transport[2] | |||
Code Kemler : 33 : matière liquide très inflammable (point d'éclair inférieur à 23 °C) Numéro ONU : 1161 : CARBONATE DE MÉTHYLE Classe : 3 Étiquette :  3 : Liquides inflammables Emballage : Groupe d'emballage II : matières moyennement dangereuses ; | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
Le carbonate de diméthyle est un composé organique de formule (CH3O)2CO de la famille des esters de carbonate. Il s'agit d'un liquide incolore inflammable à l'odeur agréable utilisé dans les réactions de méthylation et comme solvant remplaçant des composés organiques volatils tels que l'acétate de tert-butyle CH3COOC(CH3)3 ou encore la butanone CH3COCH2CH3. Le carbonate de méthyle est souvent considéré comme un composé « écologique »[4].
Le carbonate de diméthyle peut être préparé en faisant réagir du phosgène COCl2 avec du méthanol CH3OH en passant par le chloroformiate de méthyle CH3OOCCl :
la réaction globale s'écrivant :
- COCl2 + 2 CH3OH → (CH3O)2CO + 2 HCl.
Cette synthèse historique n'est plus guère employée en raison de la toxicité du phosgène et a été remplacée par d'autres réactions alternatives. Le carbonate de diméthyle est aujourd'hui produit industriellement par transestérification du carbonate de propylène C4H6O3, qui permet également de produire du propylène glycol CH3–CHOH–CH2OH, ou encore en faisant réagir ensemble du monoxyde de carbone CO, du méthanol CH3OH et de l'oxygène O2[5].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a b c d e f g h et i Entrée « Dimethyl carbonate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 février 2013 (JavaScript nécessaire).
- ↑ (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1).
- ↑ (en) Charles B. Kreutzberger, « Chloroformates and Carbonates », Kirk-Othmer Encyclopedia of Chemical Technology, (lire en ligne) DOI 10.1002/0471238961.0301180204011312.a01.pub2.
- ↑ (en) Pietro Tundo et Maurizio Selva, « The Chemistry of Dimethyl Carbonate », Accounts of Chemical Research, vol. 35, no 9, , p. 706-716 (lire en ligne) DOI 10.1021/ar010076f.
Article connexe
 Portail de la chimie
Portail de la chimie











