Enllaç C-Rh
Els compostos d'organorodi (o compostos orgànics del rodi) són compostos químics que contenen un enllaç químic entre carboni (C) i rodi (Rh) (enllaç C-Rh).
-
 Dímer de clorur de rodi ciclooctadiè
Dímer de clorur de rodi ciclooctadiè
La química de l'organorodi és la química dels compostos organometàl·lics que contenen un enllaç químic carboni-rodi (C-Rh),[1] i l'estudi del rodi i els seus compostos com a catalitzadors en reaccions orgàniques.
Com a catalitzadors s'utilitzen compostos d'organorodi estables i intermedis transitoris d'organorodi, com ara la hidroformilació d'olefines, la hidrogenació d'olefines, la isomerització d'olefines i el procés Monsanto.[2]
Classificació en funció dels principals estats d'oxidació
Els compostos organometàl·lics de rodi comparteixen moltes característiques amb els de l'iridi (Ir), però menys amb el cobalt (Co). El rodi pot existir en estats d'oxidació de -III a +V, però el rodi(I) i el rodi(III) són els més comuns. Els compostos de rodi(I) (configuració d8) solen aparèixer amb geometries bipiramidals quadrades planes o trigonals, mentre que els compostos de rodi(III) (configuració d6) solen tenir una geometria octaèdrica.[2]
Rodi(0)
Els complexos de rodi(0) són carbonils binaris. Els exemples principals són el dodecacarbonil de tetrarodi, Rh₄(CO)₁₂, i l'hexadecacarbonilhexarodi, Rh₆(CO)16. Aquests compostos s'obtenen per carbonilació reductora de sals de rodi(III) o Rh₂Cl₂(CO)₄. En contrast amb l'estabilitat del Co₂(CO)₈ homòleg, Rh₂(CO)₈ és molt labil.
Rodi(I)
Els complexos de rodi(I) són catalitzadors homogenis importants. Els complexos comuns inclouen clorur de carbonil de bis(trifenilfosfina)rodi, dímer de clorobis(etilè)rodi, dímer de clorur de (ciclooctadiè)rodi, dímer de clorobis(ciclooctè)rodi, dicarbonil(acetilacetonat)rodi(I) i clorur de carbonil de rodi. Encara que no és formalment organometàl·lic, el catalitzador de Wilkinson (RhCl(PPh₃)₃), s'inclou a la llista de catalitzadors importants. Els complexos simples d'olefina com el dímer de clorobis(etilè)rodi, el dímer de clorobis(ciclooctè)rodi i el dímer de clorur de rodi ciclooctadiè s'utilitzen sovint com a fonts de «RhCl», aprofitant la labilitat dels lligands alquens o la seva susceptibilitat a l'eliminació per hidrogenació. (η5-Cp)RhL₂ es deriven de Rh₂Cl₂L₄ (L = CO, C₂H₄).
Rodi(II)
A diferència de la prevalença dels complexos de cobalt(II), els compostos de rodi(II) són rars. El compost sandvitx rodocè n'és un exemple, fins i tot existeix en equilibri amb un derivat dimèric Rh(I). Encara que no és organometàl·lic, l'acetat de rodi(II) (Rh₂(OAc)₄) catalitza ciclopropanacions mitjançant intermedis organometàl·lics. Els complexos de porfirina de rodi(II) reaccionen amb metà.[3]
Rodi(III)
El rodi se sol subministrar comercialment en estat d'oxidació Rh(III), el reactiu de partida principal és el triclorur de rodi hidratat. Aquest últim reacciona amb olefines i amb CO per donar complexos organometàl·lics, sovint concomitants amb la reducció a Rh(I). Els complexos de ciclopentadienil de rodi inclouen el mig sandvitx dímer de diclorur de rodi pentametilciclopentadienil.
Rodi(V)
Es necessiten lligands donants forts (hidrur, silil, boril) per estabilitzar Rh(V). Aquest estat d'oxidació s'invoca en les reaccions de borilació.
-
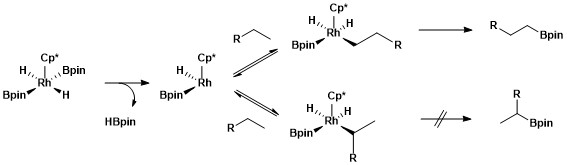 Les reaccions de borilació catalitzades per Rh impliquen intermedis Rh(V).
Les reaccions de borilació catalitzades per Rh impliquen intermedis Rh(V).
Metal·locicles
Els compostos ciclometal·lats del rodi constitueixen una classe important de química organometàl·lica. Tot i que aquests compostos estan ben documentats a la literatura, els ciclometal·lats de rodi(III) amb funció azo són de recanvi. Un exemple típic d'aquesta categoria és el nou complex ortometal·lat hexacoordinat tiolat de rodi(III) trans-[Rh(C∧N∧S)Cl(PPh₃)₂], que es va sintetitzar a partir de benzil 2-(fenilazo)fenil tioèter i RhCl₃·3H₂O en presència d'excés de PPh₃ via in situ escissions d'enllaç C(sp2)−H i C(sp3)−S. Aquest és el primer exemple d'un compost de coordinació de lligand (fenilazo)tiolat. El mecanisme de formació del derivat d'azobenzè ortometal·lat es va descriure mitjançant la coordinació inicial de l'azo-nitrogen seguida de la substitució electròfila a l'anell de fenil penjant. PPh₃ té un paper crucial en el procés d'escissió C(sp3)-S. És probable que la divisió reductora mitjançant un mecanisme de transferència d'electrons únics (SET) sigui operativa per a la divisió de l'enllaç C−S. A diferència del compost anàleg (fenilazo)fenolat, el complex tiolat ortometal·lat presenta una ona oxidativa totalment reversible a 0,82 V vs Ag/AgCl i se suposa que aquesta resposta es centra principalment en l'àtom de sofre del tiolat.[4]
Algunes aplicacions
Malgrat el seu alt cost, es confia molt en el rodi com a catalitzador comercial.
Síntesis d'àcid acètic i anhídrid acètic
El procés Monsanto és un mètode industrial per a la fabricació d'àcid acètic per carbonilació catalítica de metanol,[5] tot i que ha estat substituït en gran part pel procés Cativa basat en iridi.
-
 El cicle catalític del procés Monsanto per a la producció d'àcid acètic
El cicle catalític del procés Monsanto per a la producció d'àcid acètic
L'espècie catalíticament activa és l'anió cis-[Rh(CO)₂I₂]−,[6] que pateix addició oxidativa amb iodur de metil. El procés relacionat d'anhídrid acètic de Tennessee Eastman proporciona anhídrid acètic per carbonilació d'acetat de metil.[7]
- CH₃CO₂CH₃ + CO → (CH₃CO)₂O
Hidroformilació
-
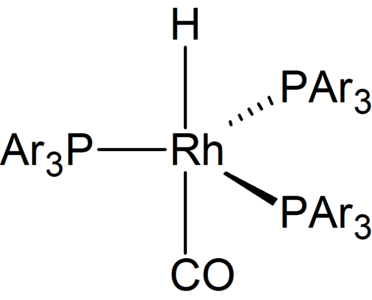 Un catalitzador d'hidroformilació a base de rodi, on PAr₃ = trifenilfosfina o el seu anàleg sulfonat Tppts
Un catalitzador d'hidroformilació a base de rodi, on PAr₃ = trifenilfosfina o el seu anàleg sulfonat Tppts
Les hidroformilacions sovint es basen en catalitzadors a base de rodi. També s'han desenvolupat catalitzadors solubles en aigua. Faciliten la separació dels productes del catalitzador.[8]
Hidrogenació
El catalitzador de Wilkinson s'utilitza com a catalitzador homogeni per a la hidrogenació d'olefines.[9] El mecanisme de catàlisi implica l'addició oxidant d'H₂, la complexació π d'alquè, la inserció migratòria (transferència intramolecular d'hidrur o inserció d'olefines) i l'eliminació reductora.
-
![L'estructura de [Rh(DIPAMP)(cod)]+, un precatalitzador per a la hidrogenació asimètrica.[10]](//upload.wikimedia.org/wikipedia/commons/thumb/3/33/IBOZABcationDownC2.png/357px-IBOZABcationDownC2.png) L'estructura de [Rh(DIPAMP)(cod)]+, un precatalitzador per a la hidrogenació asimètrica.[10]
L'estructura de [Rh(DIPAMP)(cod)]+, un precatalitzador per a la hidrogenació asimètrica.[10]
Els catalitzadors d'organorhodi(I) catiònics són útils per a hidrogenacions asimètriques, que s'apliquen a productes bioactius com ara agents farmacèutics i agroquímics.[11]
Altres reaccions
La reducció de nitrobenzè és una altra reacció catalitzada per aquest tipus de compost:
Referències
- ↑ Komiya i Hurano, 1997.
- ↑ 2,0 2,1 Crabtree, 2005.
- ↑ Bradford, Wayland i Sherry, 1991, p. 5305-5311.
- ↑ Pramanik et al., Stoeckli-Evans, p. 429-438.
- ↑ Cheung, Tanke i Torrence, 2002.
- ↑ Harwig, 2010.
- ↑ Zoeller et al., Polichnowski, p. 73-91.
- ↑ Cornils i Herrmann, 1998.
- ↑ Hartwig, 2010.
- ↑ Drexler, H. J; Zhang, Songlin; Sun, Ailing; Spannenberg, A; Arrieta, A; Preetz, A; Heller, D «Cationic Rh-bisphosphine-diolefin complexes as precatalysts for enantioselective catalysis––what information do single crystal structures contain regarding product chirality?» (en anglès). Tetrahedron: Asymmetry, 15, pàg. 2139-2150. DOI: 10.1016/j.tetasy.2004.06.036.
- ↑ Knowles, 2002, p. 1998.
Bibliografia
- Bradford, B.; Wayland, Sujuan Ba; Sherry, Alan E. «Activation of Methane and Toluene by Rhodium(II) Porphyrin Complexes» (en anglès). J. Am. Chem. Soc., 113, 1991. DOI: 10.1021/ja00014a025.
- Cheung, Hosea; Tanke, Robin S.; Torrence, G. Paul. «Acetic Acid». A: Ullmann's Encyclopedia of Industrial Chemistry (en anglès). Weinheim: Wiley-VCH, 2002. DOI 10.1002/14356007.a01_045.
- Cornils, B.; Herrmann, W. A. Aqueous-Phase Organometallic Catalysis (en anglès). Weinheim: VCH, 1998.
- Crabtree, Robert H. The Organometallic Chemistry of the Transition Metals (en anglès). Wiley-Interscience, 2005. ISBN 0-471-66256-9.
- Hartwig, John F. Organotransition metal chemistry- From bonding to Catalysis. University Science Books, 2010. ISBN 978-1-891389-53-5.
- Knowles, William S. «Asymmetric Hydrogenations (Nobel Lecture)» (en anglès). Angewandte Chemie International Edition, 41, 2002. DOI: 10.1002/1521-3773(20020617)41:12<1998::AID-ANIE1998>3.0.CO;2-8.
- Komiya, S; Hurano, M. Synthesis of Organometallic Compounds: A Practical Guide (en anglès). Sanshiro Komiya Ed, 1997.
- Pramanik, K.; Das, U.; Adhikari, B.; Chopra, D.; Stoeckli-Evans, H. «RhCl₃-Assisted C-H and C-S Bond Scissions: Isomeric Self-Association of Organorhodium(III) Thiolato Complex. Synthesis, Structure, and Electrochemistry» (en anglès). Inorg. Chem, 47(2), 2008. DOI: 10.1021/ic7016006. PMID: 18161963.
- Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. «Eastman Chemical Company Acetic Anhydride Process» (en anglès). Catalysis Today, 13(1), 1992. DOI: 10.1016/0920-5861(92)80188-S.



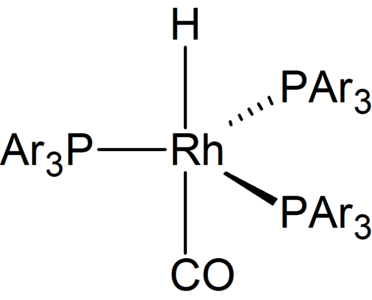
![{\displaystyle {\ce {{\overset {alque}{RHC=CH2}}+{CO}+H2->[{\ce {HRh(CO)(PPh3)3}}][{\text{hidroformilacio}}]{\overset {aldehid}{RCH2CH2CHO}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b53648cdda537b54cb195037d7add9dd26eb0bb1)
![L'estructura de [Rh(DIPAMP)(cod)]+, un precatalitzador per a la hidrogenació asimètrica.[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/33/IBOZABcationDownC2.png/357px-IBOZABcationDownC2.png)
![{\displaystyle {\ce {{\overset {nitrobenze}{PhNO2}}+ {C6H6}+ 3CO ->[{\ce {Rh6(CO)16}}] {PhNHCOPh}+ {2CO2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/faa045e5064619d893d628324e51fa402379f8a1)

